Objetivo
Mediante esta simulación, se pretende poner de manifiesto la gran cantidad de energía que es necesario transformar en calor para elevar apreciablemente la temperatura de un volumen pequeño de agua.
Experimento
Mediante el experimento de Joule se determina el equivalente mecánico del calor, es decir, la relación entre la unidad de energía (J= julio) y la unidad de calor (cal= caloría).
Dispositivo
Usaremos un calorímetro que es un recipiente aislado térmicamente (adiabático, es decir que no intercambia ni materia ni energía con el entorno). El calorímetro contiene una cierta cantidad de agua, con un termómetro para medir su temperatura, un eje con unas paletas que se ponen en movimiento por la acción de una pesa, tal como se muestra en la simulación.
Fundamento
La pesa, que se mueve con velocidad prácticamente constante, pierde energía potencial. Como consecuencia, el agua agitada por las paletas se calienta debido a la fricción.
- Bloque de masa M: Al caer, su Ep disminuye debido a que transfiere su energía a las paletas mediante la realización de un trabajo.
- Paletas: Transforman la Ep perdida en calor, debido a la fricción ocasionada por su movimiento circular dentro del agua.
- Agua del calorímetro (de masa m): Aumenta su temperatura al recibir el calor generado mediante la fricción de las paletas.
En la simulación de la experiencia de Joule, se desprecia el equivalente en agua del calorímetro, del termómetro, del eje y de las paletas, la pérdida de energía por las paredes aislantes del recipiente del calorímetro y otras pérdidas debidas al rozamiento en las poleas, etc.
Variables
Bloque:
- M es la masa del bloque que cuelga.
- h su desplazamiento vertical, es decir su distancia máxima de caída.
- g=9.8 m/s2 la aceleración de la gravedad
- m la masa de agua del calorímetro
- T0 la temperatura inicial del agua (en nuestra simulación siempre 10ºC)
- T la temperatura final (ºC)
- c es el calor específico del agua que por definición vale c=1 cal/(g ºC)
La conversión de energía mecánica íntegramente en calor se expresa mediante la siguiente ecuación
M g h = mc(T-T0) . J(J/cal)
Ep(J) = Q(cal) . J(J/cal)
J representa el factor de conversión de Julios a calorías.
Tareas
1. Vamos a realizar una análisis gráfico de los resultados que proporciona la simulación. Para ello fija las condiciones que se indican y mediante el botón de Inicio/Pausa, completa los datos de la tabla siguiente para realizar 6 experimentos diferentes, con 6 medidas en cada una. En todos los casos, la primera de las medidas corresponde con los valores iniciales. Intenta que las 6 medidas estén lo más distanciadas posible entre sí.
2. Para cada una de las 6 experiencias diferentes representa los valores que has medido de trabajo realizado -W(J)- frente a calor absorbido por el agua -W(cal), es decir en el eje OY representamos W(J) y en el eje OX representamos los valores de W(cal). Calcula la pendiente en cada uno de los casos. Puedes ayudarte de esta calculadora, o de esta otra, pero en tu informe voy a evaluar el procedimiento matemático que has empleado para calcular la pendiente.
¿Qué representa la pendiente de cada línea?
Las 6 representaciones (una por cada experiencia) tienen que realizarse en una hoja de papel milimetrado. Si tienes papel milimetrado, puedes usarlo. Si no es así, puedes usar esta web para imprimirte una hoja. Cuando sigas los pasos de la imagen, nos presenta un pdf listo para imprimir.
3. Comprueba en cada experiencia que el calor específico del agua es el que se indica. Para ello tendrás que utilizar correctamente esta expresión y el factor de conversión que has medido.
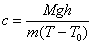
Cuestiones
- Expresa el calor específico de agua en unidades mecánicas y termodinámicas.
- Este factor de conversión que has determinado, ¿valdría para cualquier sustancia? Justifica tu respuesta.
- Exactamente, ¿qué significa que el calor específico del agua es 4180 J/(kg.K)?
- Los valores de los calores específicos que se describen para algunas sustancias son los indicados. Cuando aportamos 10.000 J de energía a cierta masa m de cada una, ¿cuál de las tres se calienta más? ¿Cuál conduce mejor el calor? ¿Tiene algo que ver la conductividad térmica con el calor específico?
- Agua: 4180 J/(kg.ºC)
- Acero: 452 J/(kg.K)
- Madera: 450 J/(kg.ºC)



If you're looking to burn fat then you certainly have to jump on this brand new personalized keto meal plan.
ResponderEliminarTo design this keto diet service, certified nutritionists, fitness trainers, and professional cooks united to produce keto meal plans that are powerful, painless, money-efficient, and enjoyable.
Since their launch in January 2019, 1000's of individuals have already completely transformed their body and health with the benefits a good keto meal plan can provide.
Speaking of benefits: in this link, you'll discover eight scientifically-proven ones offered by the keto meal plan.