Gracias Gema (la pianista), por tu aportación.
La etiqueta del producto indica su modo de uso y su composición química:
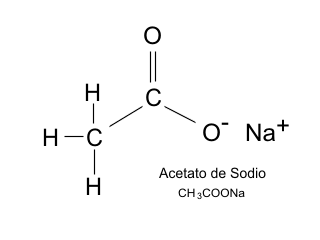
Tras investigar en la Red, observo que el misterioso líquido es acetato de sodio trihidratado y que entre sus variadas aplicaciones está la que estamos mencionando.
Datos sobre el acetato de sodio.
 Punto de fusión: 58ºC, por lo que a temperatura ambiente debería ser sólido.
Punto de fusión: 58ºC, por lo que a temperatura ambiente debería ser sólido.- Calor latente de fusión: aproximadamente 264 a 289 kJ/kg, es decir necesitamos aproximadamente 264 kJ de energía para la fusión de 1 kg de acetato de sodio.
- Entalpía de formación estándar:
- Sólido: -170,45 kcal/mol
- Disolución acuosa 400: -175,45 kcal/mol
- Energía libre de Gibss estándar:
- Disolución acuosa 400: -152,31 kcal/mol
Pues con los datos aportados es muy sencillo.
- Nos encontramos con un líquido que en realidad es una disolución sobresaturada de acetato de sodio en la que el disolvente es el agua que proviene de las moléculas de hidratación.
- Las disoluciones sobresaturadas son sistemas inestables que evolucionan rápidamente a un sistema de menor energía y por lo tanto más estable. En nuestro caso el germen o núcleo de la cristalización es la vibración producida por la chapita metálica, pero como veis, puede ser una sencilla vibración.
- Desde el punto de vista termodinámico, la formación de la fase sólida (cristalización del exceso de soluto que no debería estar disuelto), es un proceso exotérmico (libera calor).

- Cuando esto ocurre, hasta que no cristaliza todo el soluto necesario para la saturación a temperatura ambiente, el sistema sigue liberando calor.
- Pero el sistema es reversible, es decir calentándolo podemos revertir el sólido a la situación inicial:
El acetato de sodio necesario se prepara tal y como se indica en este vídeo. Su comportamiento es sorprendente.



No hay comentarios:
Publicar un comentario